胃及幽门疾病的创新内镜治疗
引言
外科医生自初就在不断地创新,借助内镜治疗原本需要开放性手术的疾病,并非新概念。1980年,Ponsky与Gauderer两位医生发明了经皮内镜下胃造瘘管,用于以往需开腹手术的儿童患者[1]。之后不到30年,井上晴洋教授开始利用壁内空间完成经口内镜下肌切开术(per oral endoscopic myotomy,POEM)来治疗贲门失迟缓这一传统的需开放或腹腔镜手术的疾病[2]。为前肠疾病患者提供了无体表切口的治疗方案,这也成为外科创新领域十年来的一大壮举。内镜手术需要一些设备,如标准/治疗内镜,可通过钳道的器械,对手术部位消化道解剖生理的认识理解,包括管壁的层次以及毗邻的腔外结构,必要时中转至腹腔镜或开放手术的能力、耐心。有时,手术操作需要多名医生和助手。本综述涵盖了一些新兴的壁内手术及腔内手术。
胃壁内手术
壁内手术历史
壁内手术需要对黏膜层与固有肌层之间的组织进行分离、扩张。在经自然腔道内镜手术(natural orifice transluminal endoscopic surgery,NOTES)中,会在壁内空间建立一黏膜瓣从而防止消化液等渗漏至腹腔内。井上晴洋教授利用这一空间对治疗贲门失迟缓症的Heller肌切开术进行改进。在本世纪初,井上教授发明并报道了POEM这一技术[2]。手术步骤包括了注射生理盐水形成黏膜下隆起、黏膜切开、分离黏膜下空间、建立黏膜下隧道、肌切开。井上教授于2008年的SAGES会议上展示了手术视频[2]。此后不久,善于创新的外科医生就将该技术拓展应用于其他前肠疾病。2012年,Kawai等报道了内镜下幽门肌切开术的动物试验[3]。他们发现使用井上教授的技术,在幽门近端作黏膜切开后分离黏膜下空间,可在内镜下辨认幽门处的环形、纵行肌,可保证精准、安全地完成内镜下肌切开。不到一年后,Khashab等提交了首例人体的内镜下幽门肌切开术治疗胃瘫,并于2017年发表了首个多中心临床研究[4,5]。
经口幽门肌切开术(Per-oral pyloromyotomy,POP)
当人们认识到腹腔镜幽门成形术作为一种促胃排空手术,可以有效治疗药物难治性胃瘫,POP作为一项创新的内镜技术可实现同样的目标[6]。
POP的适应证是是胃瘫,常见病因包括糖尿病、吻合口、自身免疫性或特发性。术前需按照美国消化病学会的指南明确胃瘫诊断,即证实有胃瘫症状、无胃梗阻或溃疡、胃排空检查显示排空延迟。胃瘫主要症状指数既可用于术前症状评估,也可用于术后比较。手术需取得患者的知情同意,讨论内容包括腹腔镜幽门成形术与内镜幽门肌切开术两种术式。手术步骤以及需要气管插管全麻也应与患者详细沟通,胃瘫的患者在麻醉诱导期间误吸的风险较高。因此,术前准备应包括:术前2天全流质饮食,术前1天清流质饮食,术前晚上禁食。
在作者所在的中心,目前已完成了数百例难治性胃瘫的POP,短期疗效很好,长期随访正在进行中[7]。我们的标准检查包括:固体食物4 h胃排空实验、诊断性胃镜检查、术前的胃瘫主要症状指数。手术的主要步骤如下,具体步骤及附带的图片、视频之前已发表[8]。
和所有手术一样,POP术前应确认设备是否准备充分。POP的常规设备包括标准诊断胃镜、透明帽、电外科内镜电刀、电外科发生器、带有可伸缩针尖的注射针、内镜止血夹。作者在实践中让患者取仰卧位。外科医生与助手站在患者的左侧。手术区通常含有至少6个位置,以3x2排的形式,供外科医生与助手站位。患者均行气管插管全麻。术前抗生素的使用取决于外科医师。手术的主要步骤包括如下(图1):
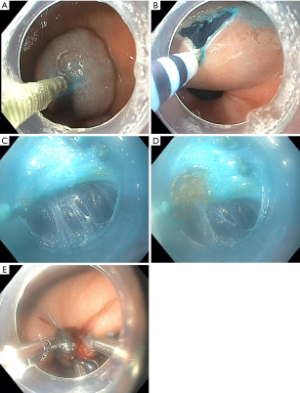
第1步(图1A): 黏膜下注射:使用注射针将含有蓝色染料的溶液注入黏膜下层。注射位置根据胃的解剖选择。作者更倾向于在幽门小弯侧近端3-5cm处。
第2步(图1B): 黏膜切开:水垫形成后,使用接于电外科发生器的内镜电刀于切割模式下作一横切口。这一过程中建立一个平整均匀的下方黏膜瓣是非常重要的。
第3步(图1C): 建立隧道:一旦内镜进入黏膜下层,则开始建立至幽门的隧道。当发现肌纤维时,继续向远端分离肌层与黏膜层。十二指肠黏膜位于幽门远端,与隧道垂直。
第4步 (图1D): 切开幽门:使用电刀的切割/电凝模式切开幽门肌。
第5步 (图1E): 黏膜切口关闭:止血夹是一种良好且简单的黏膜闭合工具。通常情况下,需要3-5个止血夹。
我们中心于2016年1月开始开展POP,并于2018年报道首个100例患者的研究。在该研究中,85名为女性,56名为特发性胃瘫,其余患者主要为糖尿病胃瘫、手术后胃瘫。研究显示短期效果良好,患者胃瘫症状及胃排空能力在主观、客观测量指标方面均有显著改善。患者术前的平均胃瘫主要症状指数评分为3.9分,术后改善至2.4分,降低1.4分,差异有统计学意义。胃排空也得到显著改善。4h平均胃残留率,术前为39.9%,至术后3月时已改善到16.3%。长期疗效仍在研究中[8]。其他的一些机构也报道了他们的研究结果。目前已发表的病例系列研究均显示了压倒性的结果,即POP患者术后的胃瘫主要症状指数、胃排空得到改善,同时并发症发生率较低。
狭窄的内镜下治疗
狭窄的病因可为良性、恶性或手术后狭窄。本章节中,作者重点关注良性及手术后狭窄。扩张是内镜治疗狭窄的主要手段,在此仅简要叙述。新兴的内镜下狭窄成形术已被应用于狭窄治疗,尤其是吻合口狭窄,将作详细阐述。在这些内镜创新技术出现之前,对于这类吻合口狭窄或袖状胃切除术后狭窄,往往需行开放或腹腔镜修复术。以下要提及的这些治疗技术,一定程度上使得上消化道手术后的并发症可以在当天就通过无体表切口的方式处理。然而,内镜外科医生仍有必要为可能的外科手术做好准备,无论是因为多次内镜尝试治疗失败或是内镜操作过程中发生无法处理的并发症如全层穿孔。
胃食管结合部的良性狭窄通常由反流性疾病引起,但幽门/十二指肠的良性狭窄则更可能与溃疡有关。良性狭窄治疗的第一步是球囊扩张;第二步是扩张联合激素注射, 若是胃食管结合部的狭窄[9],可使用标准胃镜行球囊扩张。内镜外科医师将内镜送至狭窄处,评估狭窄的大小后选择首次扩张球囊的大小。若标准内镜可以通过狭窄,则意味着狭窄直径至少为12 mm。将内镜视野保持在狭窄的近端。沿工作钳道送入球囊导管并穿过狭窄,压力枪与球囊导管相连,注射生理盐水以维持可控的径向扩张力,不同的压力维持60 s。内镜医师可以回拉球囊导管,改变球囊的左右滑轮方向,使用蓝色冲洗按钮创建一个水界面,从而观察狭窄扩张情况(图2)。扩张通常会引起出血,在扩张过程中可通过球囊观察到。若在扩张过程中出现一个“黑色区域”,则表明全层穿孔可能。这一扩张技术也常被用于袖状胃切除后狭窄的治疗[10]。
狭窄是前肠手术的并发症之一,无论是食管裂孔疝修补和胃底折叠术、良/恶性疾病行部分或全胃切除、减重术后的胃空肠吻合口或袖状胃切除术后,通常都将球囊扩张作为一线治疗。操作与上文相同,对于吻合口狭窄,需将球囊导管越过吻合口,狭窄是减重手术最常见的并发症之一。Roux-en-Y胃旁路术后,狭窄主要见于胃空肠吻合口,而袖状胃切除术后,狭窄主要见于胃角水平。若为减重手术后的胃空肠吻合口狭窄,扩张的目标直径要稍小(18 mm),以防止体重反弹。本综述配套了球囊扩张联合支架置入治疗胰十二指肠术后的胃空肠吻合口狭窄的手术视频,由Matthew Allemang和John Rodriguez(克利夫兰医学中心)提供。
吻合口狭窄通常发生于术后第3-4周,但也可更早或更晚出现。症状包括腹胀、反流、反酸、呕吐、体重下降[11]。当多次球囊扩张治疗仍失败(一般尝试至少3次的扩张联合激素注射),作者会采用内镜下狭窄成形术(视频1)。
内镜下狭窄成形术
内镜下狭窄成形术在患者全麻、仰卧位下进行。手术需要内镜电刀、电外科发生器、标准胃镜。作者更倾向于使用金探针电凝导管标记切口,在患者左侧由助手协助完成手术。进镜至狭窄口处,使用金探针导管标记拟定的狭窄切开位置。然后用针刀完成狭窄成形术,步骤包括以环周的形式分多次对瘢痕组织作放射状切开。狭窄成形术后置入支架,可降低再瘢痕化导致食管直径回缩的风险,提高并维持治疗效果。
袖状胃切除术后的狭窄通常见于胃角水平。患者可表现为恶心、上腹痛,无法进食、发育不良。通常情况下,先进行上消化道造影检查,再进行胃镜检查明确诊断。治疗的首选方式类似于上文提及的良性胃食管结合部狭窄、吻合口狭窄。然而,对于这类狭窄,在行球囊扩张时可安全地扩张至30 mm。若上述治疗失败,可考虑一种新手术即隧道下狭窄切开术,由De Moura等首次报道,采用的是壁内手术相关技术,步骤包括黏膜切开、黏膜下隧道建立[12]。
隧道内镜下狭窄切开术
这一创新手术最近刚出现,目前还没有足够证据支持其应用,但初步报道的结果是成功的,并且其理念与技术是合理的,均源于现有的内镜技术。所需器械包括:标准胃镜、斜透明帽、注射针、内镜电刀、止血夹或其他内镜缝合装置。
第1步:标准内镜检查狭窄的情况。
第2步:于狭窄近端3-5 cm处黏膜下注射使形成一水垫。
第3步:内镜电刀行黏膜切开。
第4步:建立黏膜下隧道,过程中持续注射生理盐水以降低穿孔风险。视纤维与瘢痕的严重程度,隧道的建立可能较为困难。不时地退出隧道来确认隧道的方向是十分重要的。
第5步:狭窄切开,使用电刀切开瘢痕组织以及下方的肌层。
第6步:使用止血夹或内镜缝合装置关闭黏膜切口。
de Moura等人制作的手术视频可于VideoGIE上观看[13]。
胃肿瘤治疗——内镜黏膜下剥离术与内镜黏膜切除术
内镜黏膜下剥离术(Endoscopic submucosal dissection,ESD)可用于治疗浅表癌前病变以及无淋巴结或远处转移的恶性病变。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐ESD用于T1a及Tis病变,这部分病变的淋巴结转移风险小于2%,而T1b病变的淋巴结转移率达8.4%[14]。日本的早期胃癌诊断量明显多于美国,因此许多ESD的数据以及技术进步也出自那里。总的来说,这一技术在美国未能得到充分利用,多数的内镜外科医师仍采用的是内镜黏膜切除术。ESD的优点是对直径大于1.5-2 cm的较大病变,仍可实现R0切除。内镜黏膜切除术使用的是圈套器,当切除较大病变时,需要采取分片的方式,不易实现R0切除以及准确的病理学评估,可能导致追加根治手术[15]。这类创新技术使得那些早期胃癌患者得以通过根治性、无切口手术治疗。ESD在器械及技术要点上与之前提及的内镜技术有相似之处。
ESD技术
虽然也可使用标准胃镜,但有许多治疗胃镜可用于ESD。有多种方法可提高R0切除率,如色素内镜、窄带成像以及最新的可实时对病变边界进行组织病理学评估的放大内镜[16]。这类诊断技术不在该综述的讨论范围。ESD在仰卧位、全麻下进行。需要电外科发生器。技术要点如下:
第1步:使用治疗/标准内镜辨别病变。
第2步:内镜下沿环周电凝标记病变范围。
第3步:黏膜下注射液体使病变与下方肌层分离。
第4步:电刀沿标记点环周切开黏膜。
第5步:在病变及肌层间作黏膜下隧道分离,可使用的电刀种类有三角刀、IT刀、剪刀等。
第6步:止血、电凝、夹闭所有可见的出血血管。
由于注射液体的隆起持久性提高,如透明质酸溶液、甘油凝胶,以及病变牵引技术的引入,ESD技术得到了有力强化[17]。近期的创新,如Mylonas等人于2017年SAGES会议上展示的多功能机器人工具,可使ESD的操作更加灵活[18]。该工具包括一个通用的透明帽携带有机器臂,由外科医生在单独的平台进行操控,可使双手灵活操作、形成操作三角,并且内镜医生不再需要控制内镜旋钮。ESD术中为了减少病变回缩,提高可视性,更简单的方法是使用斜形透明帽以及携带有注水孔或圈套孔的帽子,然而许多远端配件目前在美国无法获得[19]。另一个有趣的牵引解决方案是缝合滑轮法,使用内镜缝合装置固定住病变黏膜的边缘,然后缝线经口拉出,助手协助将黏膜从下方的肌层牵离。这可以顶起黏膜下纤维,使得黏膜下层组织保持张力,使病变处的黏膜下分离更容易[20]。
良性胃息肉的内镜治疗
胃息肉最常见于因其他原因行诊断性胃镜检查而偶然发现。增生性息肉是胃黏膜的一种癌前病变,与胃癌风险升高有关。最新的美国消化内镜学会指南建议,任何大于0.5 cm的增生性息肉均应行切除。内镜黏膜切除术可明确增生性息肉的诊断。腺瘤性息肉的恶变潜能更高,理想的治疗方式是ESD,可降低局部复发风险,内镜随访可助于防止复发。多篇报道显示大的或多发的胃窦息肉可引起胃流出道梗阻,患者有时表现为缺铁性贫血、间歇性梗阻症状、体重下降,一篇个案报道了带蒂胃息肉脱垂至十二指肠压迫Vater壶腹,从而诱发胰腺炎[21]。胃窦的多发息肉以增生性最为常见,可能是由于胆汁反流、幽门螺杆菌感染或反应性胃炎等相关的炎症。任何有症状的息肉必须切除,并进行病理评估。此外,必须处理炎症的病因[22]。以上提及的内镜黏膜切除术、ESD技术可为良性息肉的处理提供参考。
胃流出道梗阻的内镜治疗
胃流出道梗阻可为良性或恶性,以上腹痛、餐后呕吐为特点,最终可伴有恶心、腹胀、早饱感及体重减轻。对于因消化性溃疡引起的瘢痕/狭窄导致的良性梗阻,参见上文中的球囊扩张部分。支架置入作为另一治疗方案,可通过治疗内镜或标准内镜于透视引导下完成。对于恶性疾病以及某些良性疾病,还有一种相对较新的技术,即利用磁铁于内镜下建立胃空肠吻合,也将在本文中提及。
治疗胃流出道梗阻的首选方式仍是外科胃空肠吻合术,无论是开放还是腹腔镜手术,维持通畅的时间最长。然而,对于合并急性或慢性胃流出道梗阻的恶性肿瘤患者,常伴有营养不良或因梗阻导致的其他代谢问题,术后并发症的发生率相当高。内镜外科医生创新了几种方式为这类患者提供更加微创的治疗,即使是在姑息治疗的情况下,也可缓解患者的梗阻,恢复进食。
若内镜或导丝仍可越过病变,那么可选择放置越过梗阻的支架。然而,由于支架可能无法完全扩张,且肿瘤可内生入支架,多数需再次干预。一般情况下,支架的半年通畅率为50%~60%[23]。最新的内镜下建立旁路的治疗技术包括哑铃样金属支架、内镜下磁压榨胃空肠吻合术。哑铃样金属支架在超声内镜引导下置入,置入方法分为两类,即辅助法、直接法。辅助法包括置入导丝,将导管越过梗阻,超声内镜进入胃内,经导管将造影剂注入空肠,通过透视或超声内镜两种方式来确认空肠袢。穿刺针进入空肠,将导丝置入空肠内,对穿刺通道多次扩张后将哑铃样金属支架释放,之后再通过球囊扩张支架,直接法则是于超声内镜确认空肠袢后直接穿刺。此外,还可利用NOTES来穿透胃壁,进入腹膜,空肠袢位于屈氏韧带稍远端,辨认后释放支架。但这仍需超声内镜的引导,在进入腹膜前,要利用导丝穿过胃壁[24]。与常见的直接放置于梗阻部位的肠道支架相比,哑铃样金属支架的优点在于组织内生发生较少,支架通畅维持时间更长。
内镜下磁压榨胃空肠吻合术是治疗恶性胃流出道梗阻的一种创新技术,其概念并不新颖,但最近又重新兴起。磁压榨吻合于2002年由Yamanouchi等首次报道,被用于胆肠吻合[25]。术中,将两个稀土磁铁(如钕或钐钴)放置于拟定吻合肠管的近端和远端,通过磁铁相互吸附,诱导两个肠腔之间受压部位的坏死。正如在胆道系统中报道的,磁压榨吻合在上、下消化道也可实现。在磁压榨吻合方面,胃空肠吻合的难度可能是最低的,因为对于更远端的吻合而言,将磁铁释放至目标肠腔是手术最困难的部分[25]。磁压榨吻合装置在人体中的首次应用,是用于小肠-小肠吻合,于2017年的SAGES会议上首次报道,磁铁是通过开放手术放置的[26]。以下介绍的磁压榨吻合技术是源于2019年的一篇病例报道,作者为一名无法耐受外科手术的肠系膜上动脉(superior mesenteric artery,SMA)综合征的老年患者完成了胃空肠吻合[27]。
内镜下磁压榨胃空肠吻合术[26]
第1步:选择磁铁的类型和尺寸。
第2步:通过轴位成像、透视、内镜来明确目标肠腔。
第3步:将内镜送至目标的远端肠腔(近端空肠)。
第4步:内镜下置入导丝,在透视下移除内镜,保持导丝远端位置固定。
第5步:沿导丝置入磁铁,使用标准前视胃镜将磁铁推至到达目标的远端肠腔。
第6步:使用活检钳将另一枚磁铁送至目标的胃区。
第7步:透视下观察磁铁是否会师。
吻合口需要5-10天方能成熟,术后还需多次扩张。在人体中进行磁压榨吻合的数据仍在不断积累。
总结
对于我们的患者所面对的上消化道疾病,相应的微创治疗方案在不断进步着,内镜设备正在迅速发展。在未来十年里,本文所提及的一些手术很有可能也会过时。胃动力障碍、前肠及减重手术的并发症、早期胃癌的诊断等问题仍将持续存在,并可能在发病率上增加。尽管内镜技术有了很大进步,对于内镜失败的病例,内镜外科医师必须时刻做好准备,转至腹腔镜或开放手术。本文并未覆盖所有胃及幽门的内镜创新手术,只着重于胃瘫的内镜治疗、胃肿瘤的ESD、前肠术后狭窄的处理、胃流出道梗阻目前的内镜治疗。其中一个发展迅速并引起了人们广泛兴趣的领域是机器人NOTES。这些机器人系统可提供操作三角及灵活性,有望提高本文所提及的各种技术的性能。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Alfredo Daniel Guerron) for the series “Advanced Laparoscopic Gastric Surgery” published in Digestive Medicine Research. The article has undergone external peer review.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/dmr-21-3). The series “Advanced Laparoscopic Gastric Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Gauderer MW, Ponsky JL, Izant RJ Jr. Gastrostomy without laparotomy: a percutaneous endoscopic technique. J Pediatr Surg 1980;15:872-5. [Crossref] [PubMed]
- Inoue H, Minami H, Kobayashi Y, et al. Peroral endoscopic myotomy (POEM) for esophageal achalasia. Endoscopy 2010;42:265-71. [Crossref] [PubMed]
- Kawai M, Peretta S, Burckhardt O, et al. Endoscopic pyloromyotomy: a new concept of minimally invasive surgery for pyloric stenosis. Endoscopy 2012;44:169-73. [Crossref] [PubMed]
- Khashab MA, Stein E, Clarke JO, et al. Gastric peroral endoscopic myotomy for refractory gastroparesis: first human endoscopic pyloromyotomy (with video). Gastrointest Endosc 2013;78:764-8. [Crossref] [PubMed]
- Khashab MA, Ngamruengphong S, Carr-Locke D, et al. Gastric per-oral endoscopic myotomy for refractory gastroparesis: results from the first multicenter study on endoscopic pyloromyotomy (with video). Gastrointest Endosc 2017;85:123-8. [Crossref] [PubMed]
- Hibbard ML, Dunst CM, Swanström LL. Laparoscopic and endoscopic pyloroplasty for gastroparesis results in sustained symptom improvement. J Gastrointest Surg 2011;15:1513-9. [Crossref] [PubMed]
- Rodriguez J, Strong AT, Haskins IN, et al. Per-oral pyloromyotomy (POP) for medically refractory gastroparesis: short term results from the first 100 patients at a high volume center. Ann Surg 2018;268:421-30. [Crossref] [PubMed]
- Lundgren M, Rodriguez JH. Peroral pyloromyotomy. Surg Clin North Am 2020;100:1193-200. [Crossref] [PubMed]
- van Boeckel PG, Siersema PD. Refractory esophageal strictures: what to do when dilation fails. Curr Treat Options Gastroenterol 2015;13:47-58. [Crossref] [PubMed]
- Deslauriers V, Beauchamp A, Garofalo F, et al. Endoscopic management of post-laparoscopic sleeve gastrectomy stenosis. Surg Endosc 2018;32:601-9. [Crossref] [PubMed]
- Ardila-Gatas J, Pryor A. Endoscopic approach for the treatment of bariatric surgery complications. Mini-invasive Surg 2020;4:16. [Crossref]
- De Moura EGH, de Moura DTH, Sakai CM, et al. Endoscopic tunneled stricturotomy with full-thickness dissection in the management of a sleeve gastrectomy stenosis. Obes Surg 2019;29:2711-2. [Crossref] [PubMed]
- de Moura DTH, Jirapinyo P, Aihara H, et al. Endoscopic tunneled stricturotomy in the treatment of stenosis after sleeve gastrectomy. VideoGIE 2018;4:68-71. [Crossref] [PubMed]
- Gastric Cancer (version 1.2018). NCCN Clinical Practice Guidelines in Oncology 2018. Available online: https://www.nccn. org/professionals/physician_gls/PDF/gastric.pdf
- Draganov PV, Wang AY, Othman MO, et al. AGA Institute Clinical Practice Update: endoscopic submucosal dissection in the United States. Clin Gastroenterol Hepatol 2019;17:16-25.e1. [Crossref] [PubMed]
- Kim JW. Usefulness of narrow-band imaging in endoscopic submucosal dissection of the stomach. Clin Endosc 2018;51:527-33. [Crossref] [PubMed]
- Kakushima N, Fujishiro M. Endoscopic submucosal dissection for gastrointestinal neoplasms. World J Gastroenterol 2008;14:2962-7. [Crossref] [PubMed]
- Mylonas GP, Vitiello V, Cundy TP, et al. CYCLOPS: A versatile robotic tool for bimanual single-access and natural-orifice endoscopic surgery. In: 2014 IEEE International Conference on Robotics and Automation (ICRA). IEEE, 2014:2436-42.
- Maple JT, Abu Dayyeh BK, Chauhan SS, et al. Endoscopic submucosal dissection. Gastrointest Endosc 2015;81:1311-25. [Crossref] [PubMed]
- Aihara H, Kumar N, Ryou M, et al. Facilitating endoscopic submucosal dissection: the suture-pulley method significantly improves procedure time and minimizes technical difficulty compared with conventional technique: an ex vivo study (with video). Gastrointest Endosc 2014;80:495-502. [Crossref] [PubMed]
- Chahla E, Kim MA, Beal BT, et al. Gastroduodenal intussusception, intermittent biliary obstruction and biochemical pancreatitis due to a gastric hyperplastic polyp. Case Rep Gastroenterol 2014;8:371-6. [Crossref] [PubMed]
- Schmocker RK, Lidor AO. Management of non-neoplastic gastric lesions. Surg Clin North Am 2017;97:387-403. [Crossref] [PubMed]
- Phillips MS, Gosain S, Bonatti H, et al. Enteral stents for malignancy: a report of 46 consecutive cases over 10 years, with critical review of complications. J Gastrointest Surg 2008;12:2045-50. [Crossref] [PubMed]
- Tyberg A, Perez-Miranda M, Sanchez-Ocaña R, et al. Endoscopic ultrasound-guided gastrojejunostomy with a lumen-apposing metal stent: a multicenter, international experience. Endosc Int Open 2016;4:E276-81. [Crossref] [PubMed]
- Yamanouchi E, Kumano R, Kobayashi K, et al. Treatment for bowel or biliary obstruction by magnetic compression anastomosis development of Yamanouchi's method and its clinical evaluation. J Nippon Med Sch 2002;69:471-5. [Crossref] [PubMed]
- Pichakron KO, Jelin EB, Hirose S, et al. Magnamosis II: Magnetic compression anastomosis for minimally invasive gastrojejunostomy and jejunojejunostomy. J Am Coll Surg 2011;212:42-9. [Crossref] [PubMed]
- Kamada T, Ohdaira H, Takeuchi H, et al. New technique for magnetic compression anastomosis without incision for gastrointestinal obstruction. J Am Coll Surg 2021;232:170-7.e2. [Crossref] [PubMed]

董弢
硕士,住院医师,南京医科大学附属常州二院胃肠病中心,第一作者于Digestive Endoscopy等期刊发表SCI论文10余篇,Digestive Diseases and Sciences审稿人。(更新时间:2021/9/24)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Lundgren M, Rodriguez J. Endoscopic innovations in gastric and pyloric disease. Dig Med Res 2021;4:9.